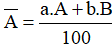Chia sẻ Bộ 11 đề ôn tập kiểm tra chương 1 môn hóa 10
Hôm nay chúng tôi xin được chia sẻ bộ đề ôn tập kiểm tra hóa 10 chương 1. Hi vọng bộ đề này sẽ giúp ích cho quý thầy cô và các em học sinh đang cần tài liệu học tập.

Nhắc lại lý thuyết
Trước tiên chúng tôi cũng xin chia sẻ một số nội dung lý thuyết về cấu tạo nguyên tử, phân tử. Trước khi giải đề học sinh cần ôn lại tổng quát kiến thức chương một môn hóa 10 để làm bài tốt hơn.
I. Nguyên tử
1. Cấu tạo nguyên tử
Gồm vỏ và hạt nhân:
– Vỏ nguyên tử: gồm các hạt electron (-).
– Hạt nhân: gồm các hạt notron và proton (+).
Nguyên tử trung hòa về điện: Số p = số e.
2. Lớp và phân lớp electron
a. Lớp electron
Lớp electron gồm các electron có mức năng lượng gần bằng nhau. Các lớp electron xếp theo thứ tự mức năng lượng từ thấp đến cao (từ gần nhân ra ngoài):
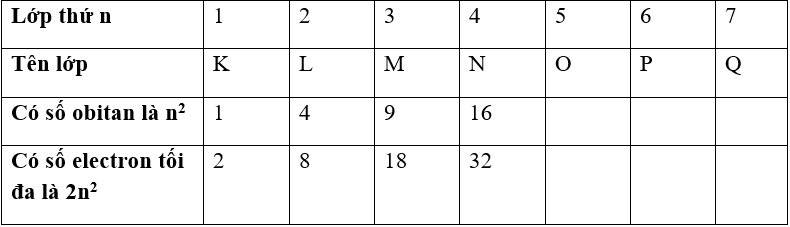
b. Phân lớp electron
– Mỗi lớp electron chia thành các phân lớp s, p, d, f gồm các electron có mức năng lượng bằng nhau:
| Phân lớp | s | p | d | f |
| Có số obitan | 1 | 3 | 5 | 7 |
| Có số electron tối đa | 2 | 6 | 10 | 14 |
– Trong 1 lớp electron thì số phân lớp = số thứ tự lớp:
| Lớp thứ | 1 | 2 | 3 | 4 |
| Có phân lớp | 1s | 2s2p | 3s3p3d | 4s4p4d4f |
– Phân lớp electron chứa electron tối đa gọi là phân lớp electron bão hòa.
3. Các quy tắc và nguyên lí phân bố electron
– Nguyên lí Pau-li
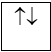
Trên 1 obitan có tối đa 2e và 2e này chuyển động tự quay khác chiều nhau:
1 obitan có 2e: 2e ghép đôi
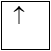
1 obitan có 1e: 1e độc thân
– Nguyên lí bền vững
Ở trạng thái cơ bản, trong nguyên tử các electron chiếm lần lượt các obitan có mức năng lượng từ thấp đến cao.
– Quy tắc Hun
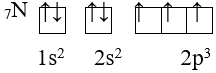
Trong 1 phân lớp, các electron sẽ phân bố trên các obitan sao cho số electron độc thân là tối đa và có chiều tự quay giống nhau.
Ví dụ:
– Thứ tự mức năng lượng: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
4. Đặc điểm của lớp electron ngoài cùng
– Các electron lớp ngoài cùng quyết định tính chất hóa học của một nguyên tố.
– Số electron lớp ngoài cùng tối đa là 8e.
+ Các nguyên tử kim loại có: 1e, 2e, 3e lớp ngoài cùng.
+ Các nguyên tử phi kim có: 5e, 6e, 7e lớp ngoài cùng.
+ Các nguyên tử khí hiếm có: 8e (He có 2e) lớp ngoài cùng.
+ Các nguyên tử có 4e lớp ngoài cùng có thể là kim loại (Ge, Sn, Pb) có thể là phi kim (C, Si).
II. Nguyên tố hóa học
– Điện tích hạt nhân Z = số p = số e.
– Số khối A = Z + N.
– Nguyên tử khối trung bình:
Bộ đề bao gồm 11 đề kiểm tra 45 phút nội dung nằm trong chương 1 nguyên tử, phân tử. Trong mỗi đề bao gồm phần trắc nghiệm và tự luận đầy đủ các dạng thường gặp quan trọng.