Lí thuyết Este – Lipit
Lí thuyết – Bài tập trắc nghiệm và tự luận chương Este-Lipit hóa học lớp 12. Phần bài tập này timgiasugioi.com xin được chọn lọc và chia sẻ đến các bạn học sinh lớp 12. Phần bài tập được chia theo từng mức độ bao gồm hai mức độ là mức độ biết và mức độ hiểu. Điều này hi vọng sẽ thuận tiện cho các bạn trong quá trình ôn tập chương este lipit.
Este-Lipid là chương đầu tiên của môn Hóa học lớp 12. Nội dung bài tập phần thuộc chương este lipit cũng chiếm một phần quan trọng trong các kỳ thi và kiểm tra lớp 12, đại học, cao đẳng…

A. ESTE
I. Định nghĩa
– Este là sản phẩm thu được khi thay thế nhóm OH trong axit cacboxylic bằng nhóm OR.
– Công thức tổng quát của một số loại este hay gặp:
+ Este no, đơn chức, mạch hở: CnH2n+1COOCmH2m+1 hay CxH2xO2 (n ≥ 0; m ≥ 1; x ≥ 2).
+ Este đơn chức: CxHyO2 hoặc RCOOR’ (x ≥ 2; y ≥ 4; y chẵn; y ≤ 2x):
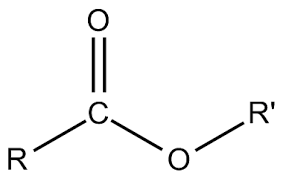
(công thức tổng quát của este đơn chức)
+ Este của axit đơn chức và Ancol đa chức: (RCOO)xR’.
+ Este của axit đa chức và Ancol đơn chức: R(COOR’)x.
+ Este của axit đa chức và Ancol đa chức: Rt(COO)xyR’x.
Lưu ý rằng số chức este là bội số chung nhỏ nhất của số chức ancol và số chức axit.
II. Danh pháp
1. Tên thay thế
Gốc Ancol + tên thay thế của axit (đổi đuôi ic thành đuôi at).
2. Tên thường
Gốc Ancol + tên thường của axit (đổi đuôi ic thành đuôi at)
III. Tính chất vật lí
– Thường là chất lỏng dễ bay hơi có mùi thơm dễ chịu của trái cây.
– Nhẹ hơn nước, ít tan trong nước, dễ tách chiết bằng phễu chiết.
– Nhiệt độ sôi của este thấp hơn nhiều so với nhiệt độ sôi của các axit và Ancol có cùng số nguyên tử C vì giữa các phân tử este không có liên kết hiđro.
– Là dung môi tốt để hòa tan các chất hữu cơ.
IV. Tính chất hóa học
1. Phản ứng thủy phân
Ry(COO)xyR’x + xyH2O ↔ yR(COOH)x + xR’(OH)y
– Phản ứng thực hiện trong môi trường axit loãng và được đun nóng.
– Muốn tăng hiệu suất của phản ứng thủy phân este phải dùng dư nước và sử dụng chất xúc tác axit, đun nóng hỗn hợp phản ứng.
– Nếu ancol sinh ra không bền thì phản ứng xảy ra theo một chiều.
2. Phản ứng thủy phân trong môi trường kiềm (phản ứng xà phòng hóa)
Ry(COO)xyR’x + xyNaOH → yR(COONa)x + xR’(OH)y
– mchất rắn sau phản ứng = mmuối + mkiềm dư.
– Với este đơn chức: neste phản ứng = nNaOHphản ứng = nmuối = nancol.
3. Phản ứng khử este bởi LiAlH4 tạo hỗn hợp ancol
4. Một số phản ứng riêng
– Este của ancol không bền khi thủy phân hoặc xà phòng hóa không thu được ancol:
RCOOCH=CH2 + H2O → RCOOH + CH3CHO
– Este của phenol phản ứng tạo ra hai muối và nước:
RCOOC6H5 + 2NaOH → RCOONa + C6H5ONa + H2O
– Este của axit fomic (HCOO)xR có khả năng tham gia phản ứng tráng gương.
(HCOO)xR + 2xAgNO3 + 3xNH3 + xH2O → (NH4CO3)xR + 2xAg + 2xNH4NO3
Nếu este có gốc axit hoặc gốc Ancol không no thì este đó còn tham gia được phản ứng cộng, phản ứng trùng hợp và phản ứng oxi hóa không hoàn toàn.
CH2=CH-COOCH3 + Br2 → CH2Br-CHBr-COOCH3
nCH2=C(CH3)COOCH3 → (-CH2-C(CH3)(COOCH3)-)n
(Poli(MetylMetacrylat) – Plexiglass – thủy tinh hữu cơ)
nCH3COOCH=CH2 → (-CH2-CH(OOCCH3)-)n
(poli(vinyl axetat) – PVA)
V. Điều chế
1. Thực hiện phản ứng este hóa giữa ancol và axit
yR(COOH)x + xR’(OH)y ↔ Ry(COO)xyR’x + xyH2O (H+, t0)
2. Thực hiện phản ứng cộng giữa axit và hiđrocacbon không no
RCOOH + C2H2 → RCOOCH = CH2
3. Thực hiện phản ứng giữa muối Na của axit và dẫn xuất halogen
RCOONa + R’X → RCOOR’ + NaX (xt, t0)
4. Thực hiện phản ứng giữa phenol và anhidrit axit
(RCO)2O + C6H5OH → RCOOC6H5 + RCOOH
VI. Nhận biết este
– Este của axit fomic có khả năng tráng gương.
– Các este của ancol không bền bị thủy phân tạo anđehit có khả năng tráng gương.
– Este không no có phản ứng làm mất màu dung dịch Brom
– Este của glixerol hoặc chất béo khi thủy phân cho sản phẩm hòa tan Cu(OH)2.
B. LIPIT
1. Khái niệm
Là những HCHC có trong tế bào sống, không tan trong nước, nhưng tan trong các dung môi hữu cơ không phân cực.
2. Phân loại
Lipit gồm: chất béo, sáp, steroit và photpholipit.
Chất béo là trieste của glixerol với các axit monocacboxylic có số chẵn C không phân nhánh (axit béo) gọi chung là triglixerit hay triaxylglixerol. Công thức chung là C3H5(OOCR)3.
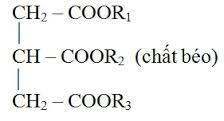
Các axit béo thường gặp là axit panmitic C15H31COOH, axit stearic C17H35COOH, axit oleic C17H33COOH và axit linoleic C17H31COOH.
3. Trạng thái tự nhiên và tính chất vật lý của chất béo
Chất béo có gốc axit no: rắn, mỡ động vật. Chất béo có gốc axit không no: lỏng, dầu thực vật
4. Tính chất hóa học của chất béo
Bản chất chất béo là este nên có những tính chất như este.
– Chỉ số axit là số miligam KOH cần dùng để trung hòa hết lượng axit béo tự do có trong 1 gam chất béo.
– Chỉ số xà phòng hóa là số miligam KOH cần dùng để xà phòng hóa hết 1 gam chất béo.
C. CHẤT GIẶT RỬA
Là những chất khi dùng cùng với nước thì có tác dụng làm sạch các chất bẩn bám trên vật rắn mà không xảy ra các phản ứng hóa học.
Đặc điểm chung về cấu tạo của các chất giặt rửa là có một đầu ưa nước và một đầu kị nước.
Hochoaonline.net giới thiệu một số bài tập, câu hỏi tham khảo dưới đây:
Chúc các em học tốt chương este lipit.